
مقایسه ی قدرت اسیدی در کربوکسیلیک اسیدها
کربوکسیلیک اسیدها دسته ای از ترکیبات آلی هستند که یک یا چند گروه عاملی کربوکسیل (-COOH) در آنها یافت می شود. در این مقاله به نام گذاری، قدرت اسیدی و خواص آن ها خواهیم پرداخت.
نام گذاری:
در روش ایوپاک برای نام گذاری کربوکسیلیک اسیدها از طرف عامل کربوکسیل، کربن ها را شماره گذاری می کنیم و بعد از ذکر شماره و نام شاخه های فرعی، تعداد کربن زنجیره ی اصلی را بر وزن آلکانوییک اسید می نویسیم.

اگر اسید مورد نظر دو عامل اسیدی داشته باشد نام گذاری آن بر وزن آلکان دی اوییک اسید است.
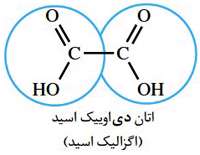
اگر عامل کربوکسیل، به حلقه ی بنزن متصل باشد به آن بنزوییک اسید می گویند.

متانوییک اسید و اتانوییک اسید دو اسید سبک هستند که علاوه بر نام ایوپاک خود یک نام معمولی هم دارند. متانوییک اسید (HCOOH) فرمیک اسید یا اسید مورچه نیز خوانده می شود، چون در نیش مورچه وجود دارد و در اثر گزش مورچه وارد بدن شده و باعث سوزش و خارش می شود. در لاتین به مورچه فرمیکا می گویند. این اسید نخستین بار از تقطیر مورچه سرخ به دست آمد.
اتانوئیک اسید (CH3-COOH) استیک اسید یا جوهر سرکه نیز نامیده می شود چون اسید موجود در سرکه است. در لاتین به سرکه استوم می گویند.
مقایسه قدرت اسیدی:
هر چه گروه های متصل به عامل کربوکسیل الکترون گیرنده تر باشند، اتم اکسیژن در عامل کربوکسیل تمایل بیش تری برای گرفتن الکترون پیوندی خود با هیدروژن دارد و راحت ترH+ را آزاد می کند و قدرت اسیدی افزایش می یابد. مهم ترین گروه های الکترون، گیرنده هالوژن ها هستند. هر چه تعداد هالوژن بیش تر باشد قدرت اسیدی بیش تر است.
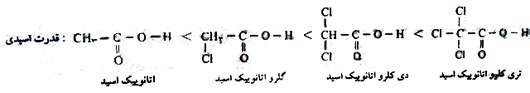
هر چه هالوژن متصل به عامل کربوکسیل، نزدیک تر باشد تاثیر الکترون گیرندگی آن بیش تر و قدرت اسیدی بیش تر است.
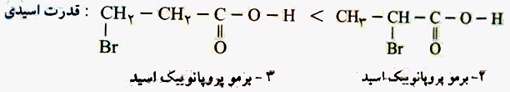
هر چه هالوژن متصل به عامل کربوکسیل، الکترونگاتیوتر باشد قدرت الکترون گیرندگی آن بیش تر و قدرت اسیدی بیش تر است.
سوال:
الکترونگاتیوی مهم تر است یا نزدیک بودن هالوژن به عامل کربوکسیل و یا تعداد بیش تر آن؟
جواب:
یک قانون کلی برای این موارد وجود ندارد. اگر مقایسه قدرت اسیدی با وجود هر یک از این موارد در هر اسید مد نظر باشد تنها راه اندازه گیری مقادیر ثابت یونش اسیدی (Ka) است.
اگر گروه های الکترون دهنده به عامل کربوکسیل متصل باشند، کمبود الکترون اکسیژن موجود در مهم ترین گروه های الکترون دهنده آلکیل ها (مانند متیل، اتیل و ... ) عامل ایجاد قدرت اسیدی است. هر چه تعداد کربن های یک آلکیل بیش تر باشد الکترون دهندگی ها آن بیش تر بوده و قدرت اسیدی کم می شود.
قدرت اسیدی : HCOOH > CH3COOH > CH3CH2COOH
انحلال پذیری:
کربوکسیلیک اسیدهای سبک (حداکثر تا چهار اتم کربن) به خوبی در آب حل می شوند امّا هر چه تعداد اتم کربن در زنجیره ی هیدروکربنی اسید بیش تر شود سر ناقطبی مولکول بزرگ تر شده و جاذبه ی آن با مولکول های قطبی آب کم می شود در نتیجه از قدرت انحلال پذیری آنها در آب کاسته می شود.
مرکز یادگیری سایت تبیان - تهیه: مهسا شاه حسینی

















